光デバイス/OLED
5.有機発光ダイオードにおけるキャリア輸送(電子供与性と電子吸引性)
正孔輸送層、電子輸送層に使える有機分子は多数提案されています。どのような基準で材料を選べばよいのか、について考えます。
無機結晶半導体ではp型半導体とn型半導体があり、p型半導体中では正孔が主たるキャリアで、n型では電子が主たるキャリアです。この2種類の導電型はどのように作られるかと言うと、例えばシリコンでは、4価のシリコンに対して3価の元素(例えばボロン(ホウ素))を微量添加(ドープ)するとp型になり、5価の元素(例えばリン)をドープするとn型になることが知られています。
多数の4価の元素からなる結晶中に3価の元素が1個入ると、その周囲では電子が1個不足した状態になります。この電子が不足している場所が正孔に相当しますが、その場所には周囲の電子が移動してくることができ、そのときには他の場所で電子が不足することになるので、見かけ上、正孔も電子同様に移動することになります。一方、5価の元素が入ると電子が過剰になり、この過剰な電子が移動することになります。
結晶半導体ではこのように人為的に導電型を作ることができます。一方、有機分子の場合は非常に多くの種類がある分子のなかから電子が移動しやすいもの、または正孔が移動しやすいものを選ぶことが基本になります。その選択の基準ですが、簡単にはつぎのように考えてよいと思います。
まず、リチウム(Li)やナトリウム(Na)などのアルカリ金属は1価の正イオン、Li+ やNa+ になりやすいことが知られています。例えばNaの場合、電子を11個もっていますが、これらの電子は1s軌道に2個、2s軌道に2個、2p軌道に6個、3s軌道に1個が入っています。この最外殻の3s軌道の電子1個が離脱した状態がNa+ ですが、これは2d軌道までが10個の電子でちょうど埋まったネオン(Ne)と同じ電子構造であり、安定です。つまりNa原子は電子を1個放出し1価の正イオンになりやすいと言えます。なお、以上にような電子配置や原子軌道については「有機分子の発光の物理」2、3項を参照して下さい。
また、フッ素(F)や塩素(Cl)などのハロゲン元素は1価の負イオン、F-、Cl- になりやすいことが知られています。Fは9個の電子をもち、2d軌道に5個の電子があり、もう1個電子が入ることによってNeと同じ構造になるため安定です。つまりハロゲン原子は電子を1個取り込みやすく、したがって周囲には電子が抜けたところができやすくなります。これが正孔となります。
有機分子の場合も同じように考えられます。正孔輸送層の材料として多く用いられている材料に芳香族アミンがあります。アミンとは構造式(e)のように窒素の周りに3個の有機基R1、R2、R3が結合した分子です。通常アミンには分類されませんが、窒素に水素が3個結合したアンモニア分子(NH3)がもっとも簡単な形です。
窒素は7個の電子をもち、最も外側の2p軌道にある3個の電子が結合に関わります。このように窒素の結合手(配位と言います)は3です。アンモニアではここに水素がそれぞれ共有結合していますからすべての配位が埋まっています。ただし、窒素の2s、2p軌道は混成軌道sp3を形成しているとも考えられ、この場合、残った2個の電子はアミンの構造図に・で示したように結合にかかわらず非共有電子対と呼ばれています。
このアンモニアを水に溶かすと、水分子の水素を引きつけてアンモニウムイオン(NH4+)になります。これは分子を立体的にみると、2個の非共有電子対が水素結合と反対側に偏って存在するため、その部分に水素が引き寄せられるためです(1)。同様にアミン類も水素原子を1個引きつけて正に帯電しやすい性質があります。これはアンモニアあるいはアミン分子側からみると電子が抜けやすいことを示していて、これがこの類いの分子では正孔がキャリアになりやすく正孔輸送材料として選ばれる理由です。この性質は電子供与性ということがあります。
電子輸送層の材料は正孔輸送層に比べると典型的材料を挙げ難いです。例えば2項で挙げたAlq3という分子がありますが、ここでは説明を簡単にするために、もっと単純なボラン(BH3)を取り上げます。ホウ素に3個の水素が結合したこの分子は不安定ですが、ここはあくまで説明のために簡単な分子を取り上げます。
ホウ素(B)は5個の電子を持ち、2s 2個、2p1個ですが、混成軌道sp2を作ります。この3つが配位となり、ここに水素が3個結合したのが、構造式(f)に示すボランです。この場合は混成軌道に空きがあり、電子が入りやすくなっています。これが電子がキャリアとなりやすく電子輸送材料の候補となる理由です。この性質を電子吸引性ということがあります。
Alq3は構造式(d)(2項参照)に示すように+3価の金属であるAlが中心にあり、ヒドロキシキノリン基は-1価です。因みにAlの配位数は6ですが、ヒドロキシキノリン基は酸素と窒素において配位できる(2座配位子という)ので、分子構造式(c)に示すような分子が形成されます。構造は複雑ですが、基本的にはボランと類似の理由で電子吸引性になります。
以上は分子の性質からの説明ですが、正確には分子軌道法(「有機分子の発光の物理」4、5項)によって計算されるHOMO(イオン化エネルギー)、LUMO(電子親和力)の値(図5-1参照)や電子の分布状態によって性質が決まることになります。正孔輸送材料はイオン化エネルギーが小さいことが必要です。HOMOから電子が励起されやすく正孔が生成されやすいことを意味します。電子輸送材料は電子親和力が大きいことが必要です。LUMOのエネルギーが小さいほど励起電子が存在しやすくなります。
具体的な例をあげてみます。前項の図4-2にならって具体的な材料について描いたのが図5-2です。各層の上に書いてある数字がLUMOのエネルギーまたは電子親和力の値で、下の数字がHOMOのエネルギーまたはイオン化エネルギーの値です。図中のエネルギーの値は文献(2)によりました。マイナス符号が付いているのは基準とする真空準位より低いエネルギーをマイナスのエネルギーとしているためです。
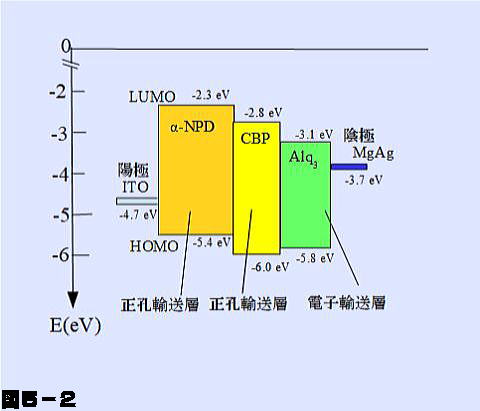
左側が陽極(ITO)で陽極側の第1層が正孔輸送層です。下に示すような構造式(g)のN,N'-ジ(1-ナフチル)-N,N'-ビフェニル-4,4'-ジアミン、略してα-NPDと呼ばれる材料を例として示しました。上記のアミノ基を2つもっています。そのHOMOのエネルギーは -5.5eVとここで使われている材料のなかで絶対値がもっとも小さくなっています。
このα-NPD層の右側にもう1層、正孔輸送層を設けています。前項の発光層に相当する層です。具体例として4,4'-N,N'-ジカルバゾール-ビフェニル(CBP)を示します(構造式(h))。これもアミノ基を2個もつ分子です。
さらにその右側の陰極に接触する層が電子輸送層で、材料は上でも触れたAlq3です。LUMOのエネルギーは -3.1eVとここで使われている材料のなかで絶対値がもっとも大きくなっています。
ただこの材料はHOMOのエネルギーが -5.8eV と小さいのが難点とされています。この例のようにHOMOのエネルギーが発光層のHOMOの値より小さいと発光層から正孔が陰極側に流れ出やすく、発光に寄与しないで失われやすいからです。
ここでは正孔輸送層、電子輸送層の典型的な例を挙げ、それぞれのはたらきを説明しましたが、図5-2の構成では実用的なOLEDとしてはまだ改良の余地があります。改善された構造については後ろの項で取り上げます。
(1)平山令明「実践量子化学入門」講談社ブルーバックス、p114
(2)特開2008-294200号
.