科学・基礎/結晶の話
4.結晶をつくる力(その2)
前項ではイオン結合について説明しました。続いてこの項では共有結合と金属結合を 取り上げます。
(2)共有結合 例えば半導体デバイスに使われているシリコン(ケイ素)Siの結晶は、シリコン原子1種のみからなっているので、正負の電荷が引き合うイオン結合では説明がつきません。 同一原子が結合して分子を作る例は多数あって、もっとも簡単な例は、図4-1に示すように水素原子が2個結合して水素分子H2が作られたり、酸素原子が2個結合して酸素分子O2が作られたりする場合です。このような結合は各原子がもっていた電子を2つの原子が共有することによって結合が生じると説明がされています。これを共有結合と言います。
この共有結合については「有機分子の発光の物理」の6項で説明しているように2つの原子が接近すると、電子は新たな分子軌道を作ります。この分子軌道のエネルギーのうち図4-2に示すように、原子軌道のエネルギーより小さい軌道が存在すれば、電子はこちらの軌道に入り、共有結合が成立します。
このように2つまたはもっと多くの原子が電子を共有して一つの分子を作るだけでなく、多数の原子が隣り合う原子と電子を共有して結晶を作る場合があります。実際に実質的に無限個とみなせるような多数の原子が互いに共有結合して有限の大きさの結晶を作ります。
シリコンの場合は原子2個や4個で分子を作ることは通常の条件ではなく、多数の原子が互いに共有結合して結晶をつくります。この場合は単純な立方格子ではなく、ダイアモンド構造という特殊な構造をとります。炭素の共有結合結晶であるダイアモンドがこの構造をとることからこの名があります。
「有機分子の発光の物理」の4項に記したように炭素(C)は、2sと2pの軌道にある計4個の電子がsp3と名付けられた新しい混成軌道と呼ばれる軌道を作り、これが4つの不対電子となって4価の元素のように振る舞うと説明されています。これはSiの場合も同じで、Siの場合は3sと3pの軌道にある4個の電子がsp3混成軌道を作ります(図4-3)。
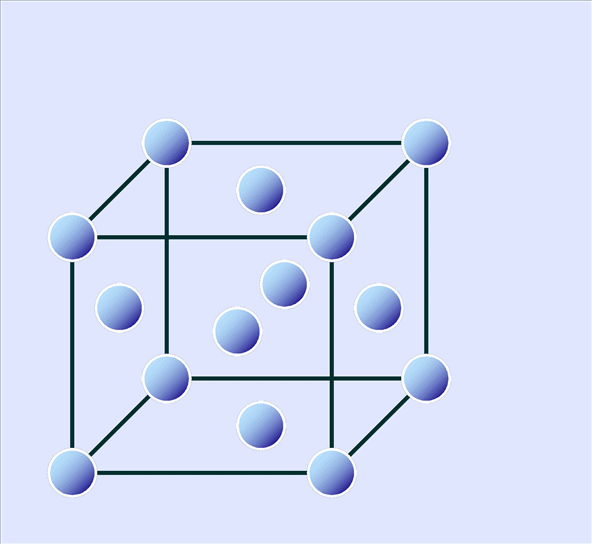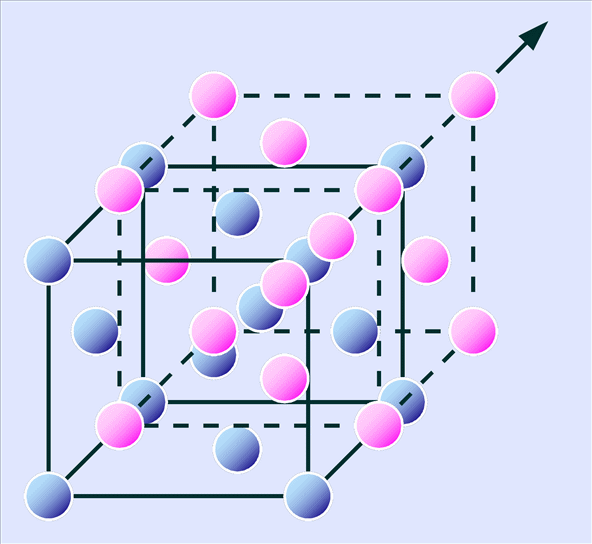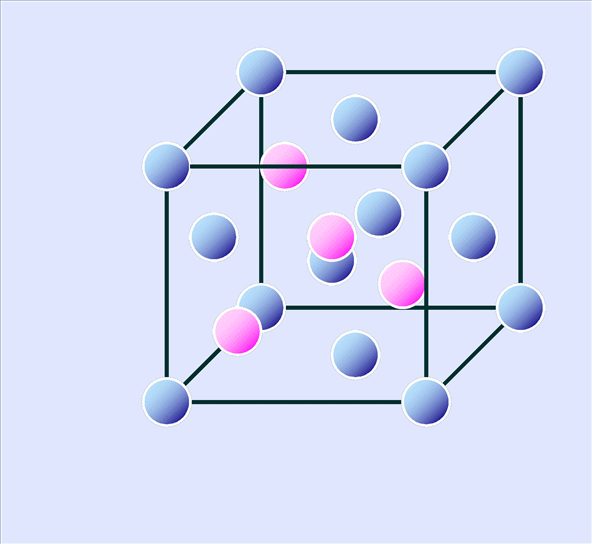
このため、Siの結晶では図4-4に示すように4つの頂点に位置する4個の原子とこれと等距離にある中心の原子1個(色を変えて示しています)が配置された正四面体構造を基本として、これが連なって結晶を形成しています。図4-4は一部分のみ示していますが、実際には3次元に連なった構造をもちます。
この正四面体の頂点が下方45°方向を向くように回転すると面心立方格子を単位格子にしたダイヤモンド構造をなしているのがわかります(図4-5)。
図4-5
これは単純面心立方格子を、その対角線方向に沿ってその長さの1/4だけ移動させて重ねるとできる構造とも表現できます(図4-6)。
図4-6
なお、図では頂点の原子と中心の原子の色を変えて示していますが、実は前項で示した閃亜鉛鉱型のZnSも同じ結晶構造を持ちます。頂点にあるのがS原子、中心にあるのがZn原子となります。
なお、二酸化ケイ素(SiO2)も同様の構造をとりますが、酸素が2つのSiの間に1つずつ入った構造となります(図4-7)。
共有結合により結晶を作る物質はそれほど多くありません。上記の炭素(C)、シリコン(Si)の他、ゲルマニウム(Ge)といったⅣ族元素、燐(P)、ヒ素(As)といったV族元素、テルル(Te)、セレン(Se)などのⅥ族元素などが該当します。
(3)金属結合 多くの金属、例えば金(Au)や銅(Cu)、アルミニウム(Al)なども1種類の原子で結晶を作ります。また複数種類の原子からなる合金も結晶を作る場合があります。
これら金属の結晶を作る力は共有結合に似ていますが、少し異なります。金属の原子は最も外側の軌道にある複数の電子を離しやすく、多数の金属原子が集合するとその周りには各原子から供給される多数の自由電子が存在します。これらの原子の束縛を逃れて自由になった電子(自由電子)が多数存在することによって原子がばらばらにならずにつなぎ止められ、図4-8に示すような固体の結晶が作られます。この自由電子が原子核をつなぎ止める結合を金属結合と呼んでいます。
単一種類の原子からなる金属結晶は多くの場合、最密充填構造をとります。Li、Na、Kなどのアルカリ金属は配位数8の体心立方格子(前項図3-4)をとります。Cu、Ag、Alなどは面心立方格子(前項図3-6)、MgやZnなどは六方最密構造(前項図3-8)をとります。配位数はいずれも12です。
体心立方格子の場合は単位格子内に2個の原子を含みます。この場合、原子の半径を \(r\)、格子定数を \(l\) とすると、\(r=\sqrt{3}/4\cdot l\) の関係があります。面心立方格子の場合は4原子を含み、\(r=\sqrt{2}/4\cdot l\) の関係となります。
\[f=\frac{4}{3}\pi r^3/l^3\]
の \(f\) を充填率と呼びますが、体心立方格子の場合 \(\sqrt{3}\pi /8\)で0.68、面心立方格子の場合は \(\sqrt{2}\pi/6\) で0.74となります。これはかなり大きい値で原子が密に詰まった状態であることを示しています。
・電気陰性度 上記のイオン結合と共有結合は実はきっちりと分けられるものではありません。もちろん同一原子間ではイオン結合はありえませんが、電子を共有する軌道をもちながら、正負のイオンの引力ももつという結合もあり得ます。このような場合、イオン結合と共有結合のどちらが優成かを判断する指標があります。それが電気陰性度です。電気陰性度は分子中で原子が電子を引きつける強さを表しますが、これには3つの定義があります。
まずもっともわかりやすいのが、マリケン(R.Mulliken)の電気陰性度 \(\chi _M\) というものでこれはイオン化エネルギー \(I\) と電子親和力 \(A\) の平均値で表されます。すなわち
\[\chi_M = (I+A)/2\]
ですが、これは「有機分子の発光の物理」8項で説明しています。
これに対してポーリング(L.Pauling)の電気陰性度 \(\chi_P\) というものがあります。原子 \(\mathsf{A}\) と \(\mathsf{B}\) の結合エネルギーの実測値を \(E(\mathsf{A}-\mathsf{B}) \) とします。一方、原子 \(\mathsf{A}\) と \(\mathsf{B}\)がそれぞれ純粋に共有結合で結合する際の結合エネルギーを \(E(\mathsf{A})\)、\(E(\mathsf{B})\) とします。このとき、\(E(\mathsf{A-B}) \) は大体 \(E(\mathsf{A})\)、\(E(\mathsf{B})\) より大きくなります。この差はイオン結合性があるために生じると考え、差 \(\Delta\) を
\[\Delta=E(\mathsf{A-B})-\sqrt{E(\mathsf{A})E(\mathsf{B})}\]
とし、原子\(\mathsf{A}\) と \(\mathsf{B}\) の電気陰性度を \(\chi_P (\mathsf{A})\)、\(\chi_ P(\mathsf{B})\) と定義し、これらは次式を満たすとします。
\[|\chi_P (\mathsf{A}) - \chi_P(\mathsf{B})| = 0.208\sqrt{\Delta}\]
1つが既知でないと決まりませんが、上式から求められるのがポーリングの電気陰性度です。
もうひとつオールレッド-ロコウ(A.L.Allred, E.G.Rochow)の電気陰性度というのがあります。これは原子と共有結合半径 \(r\) にある電子との引力 \(F\) に基づいて電気陰性度が決まると考えて定義されたもので、詳細は略しますが、
\[\chi_{AR} = {3590(Z_{eff} -0.35)/r^2}+0.744\]
で定義されます。\(Z_{eff} \) は有効核電荷で、\(Z_{eff}=Z-S\) です。\(Z\) は原子番号、\(S\) は遮蔽定数です。
この電気陰性度は、大雑把に言えば、周期律表の右側で大きく、原子番号が小さいほど大きくなります。このためハロゲンのフッ素がもっとも大きくなり \(\chi_{P}=3.98\)、アルカリ金属、例えばNaでは \(\chi_{P} =0.93\) と小さくなります。
この電気陰性度によって種々の化合物の結合がイオン結合か共有結合か金属結合かを判定できます。この目安を示したのがファン・アーケル(A.E.Van Arkel)-ケテラー(J.A.A.Ketelaar)の三角形です。これは横軸に2つの元素の電気陰性度の平均値 \(\chi_{mean} \)をとり、縦軸に2つの元素の電気陰性度の差 \(\Delta\chi\) をとって、図4-9のような三角形を描いたものです。
すると \(\Delta\chi\) の大きい部分はイオン結合性、\(\Delta\chi\) が小さく、平均の \(\chi_{mean} \)が大きいと共有結合性、\(\Delta\chi\) も \(\chi_{mean}\)も小さいと金属結合となることが明らかになります。図では領域の境界を単純に直接で区切っていますが、実際には領域は入り組んでいます。境界部分に来るような分子では両方の性質を併せ持った状態と言えます。
\(\Delta\chi=0\) の\(\chi_{mean}\) 軸上は同一元素間の結合を示しますが、F2をはじめ、O2やC間の結合は \(\chi_{mean}\)が大きく、典型的な共有結合性であることが示されています。一方、アルカリ金属であるCsとハロゲン元素のFやClとの結合は典型的なイオン結合となります。
イオン結合と金属結合の間の領域にジントル(Zintl)相という耳慣れない状態が示されています。特殊なのでここでは立ち入りませんが、この相は他の3種類のどの結合とも異なる結合状態とされています。
.